如何逆转细胞命运?这个问题在科学界已经研究了几十年之久,然而截至目前,科学家仍在寻求一种更为简单、精准、安全并可以应用于临床的技术。 北京时间4月13日23时,顶级学术期刊《自然》(Nature)在线发表了北京大学博雅讲席教授、干细胞研究中心主任邓宏魁团队的一项最新研究,题为“化学重编程人类成体细胞为多能干细胞”( Chemical reprogramming of human somatic cells to pluripotent stem cells)。这项突破性研究成果首次在国际上报道了使用化学小分子诱导人成体细胞转变为多潜能干细胞,实现了人体细胞发育过程的“大逆转”。
邓宏魁在接受澎湃新闻(www.thepaper.cn)记者专访时表示,“我们一直在追求一种更加简单、精准和可控的方法,不涉及任何复杂操作,仅仅在细胞培养基中添加一些特定的外源化学小分子,就能控制细胞的特性,甚至逆转发育特征。”他认为,这种“最简单”的操控细胞命运的方式,却可以带来质的飞跃。
涡虫、蝾螈等低等动物拥有超强的再生能力,而人在进化过程中丧失了这种能力。显而易见的一点是,在老龄化日趋严重的当下,“一个关键的社会问题是我们能不能实现健康的老龄化?”包括邓宏魁在内的该领域科学家认为,提升人的再生能力,能为解决衰老过程引起而目前传统医学不能解决的重大疾病提供一种新的手段。
该领域朝着这一目标的尝试已经历了几十年。上世纪60年代,英国科学家约翰·戈登(John Gurdon)在爪蟾中开发了细胞核移植技术;1997年,英国Roslin研究所的伊恩·维尔穆特(Ian Wilmut)团队利用该技术制备了克隆羊“多莉”,证明了哺乳动物高度分化的体细胞可以被逆转为早期胚胎的初始状态,并获得了发育为整个动物个体的能力。2006年,日本科学家山中伸弥(Shinya Yamanaka)报道了使用转基因的方式可以将小鼠成体细胞重编程为多潜能干细胞,被称为诱导多潜能干细胞(iPS细胞)。
邓宏魁等人的化学重编程方法是继上述“细胞核移植”和“转录因子表达”之后的新一代的、由我国自主研发的人多潜能干细胞制备技术,同时解决了我国干细胞和再生医学的发展中底层技术上的“瓶颈”问题。
邓宏魁团队在细胞重编程和干细胞研究领域深耕了十几年。此前的2013年,其团队在顶级学术期刊《科学》(Science)发表了一项原创性的研究成果,即不依赖细胞内源物质,仅使用外源性化学小分子就可以逆转细胞命运,将小鼠的体细胞重编程为多潜能干细胞(CiPS细胞)。将类似的方法推衍到人类细胞上,他们又整整走了9年时间。
经过长期坚持和探索,邓宏魁团队突破了人类成体细胞化学重编程的瓶颈问题。破题思路仍然来源于低等动物,“它们是怎么实现再生的?”邓宏魁谈到,团队回到了这一本质问题。蝾螈等低等动物在受到外界损伤后其体细胞会自发的改变本身的特性,进而通过被称为“去分化”的过程获得一定的“可塑性”,借助这一可塑的中间状态从而实现肢体的再生。
研究团队假设,重新建立这种可塑状态是小分子解锁人类体细胞“身份”,并允许生成人多潜能干细胞的关键。受此启发,研究团队把工作主要分成了两个步骤。“第一步不是实现多潜能干细胞,而是去模拟低等动物这条路,如果第一步实现了,后面一步实现多潜能干细胞可能就很容易了。”在邓宏魁看来,第一步是真正具有跨越意义的一步,“这或可以真正打开人类再生医学的大门。”
沿着上述思路,研究团队进行了大量化学小分子的筛选和组合,最终发现高度分化的人成体细胞在特定的化学小分子组合的作用下,同样可以发生类似低等动物中去分化的现象,并获得具有一定可塑性的中间状态。在此基础上,研究团队最终实现了人CiPS细胞的成功诱导。
总体而言,他们通过创造一个中间的可塑性状态来实现人类体细胞的化学重编程,并获得了和胚胎干细胞高度相似的人CiPS细胞。整个化学重编程轨迹分析揭示了早期中间塑性状态的产生,在此过程中发生化学小分子诱导的细胞去分化现象。比对分析发现,该过程与蝾螈肢体再生的去分化过程相似,激活了与发育和再生相关的关键基因。
更重要的是,研究团队还发现了调控这一类再生过程和细胞可塑性的关键信号通路,即JNK通路是化学重编程的主要障碍,抑制JNK通路对于通过抑制炎症信号来诱导细胞可塑性和再生相关程序是必不可少的。因此,JNK通路可能成为研究人类再生的新靶点。
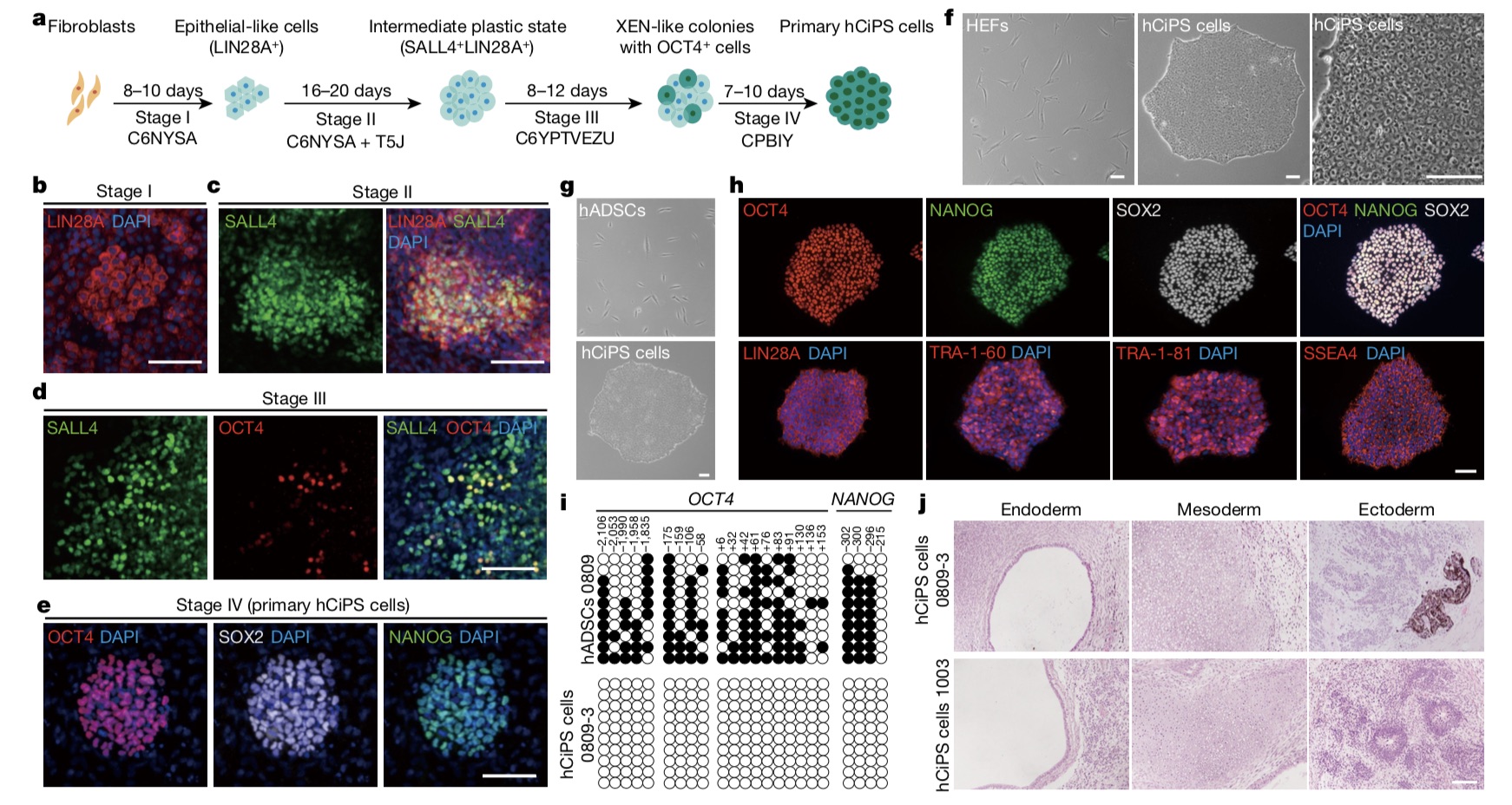
使用化学小分子实现人CiPS细胞的成功诱导。
邓宏魁认为这是一种更为精准可控的细胞命运调控方法。化学小分子操控的方式,“把重编过程变成了像火车可以停靠一样,它可以停在任何一个阶段,也就说是一个可以精细调控的过程。”
另外,相比传统方法,小分子诱导体细胞重编程技术作为非整合方法,规避了传统转基因操作引发的安全问题,有望成为更安全的临床治疗手段。
值得关注的是,今年的2月4日,邓宏魁团队和中国医学科学院/北京协和医学院彭小忠研究组及天津市第一中心医院沈中阳研究组合作在《自然-医学》(Nature Medicine)发表了一项研究,他们建立了人CiPS细胞向胰岛细胞的分化制备方案,并由此获得了干细胞来源的功能成熟的胰岛细胞;进一步将其移植入非人灵长类糖尿病动物模型中,系统验证了人CiPS细胞分化的胰岛治疗糖尿病的安全性和有效性。
邓宏魁透露,在糖尿病猴子模型上试验之后,目前正在积极推进临床。“因为在猴子上的结果很好,我们还是很有信心的。”尽管目前这些初步的迹象表明,这项技术在安全性上有优越性,他同时强调,“安全性依然是最关键的,这个还要经过仔细的长期的对比研究,但小分子的优化有巨大空间。” (澎湃新闻)

































